Fra LyLe Fokus, maj 2020:
Chimeric Antigen Receptor Therapy eller bare CAR-T-celleterapi er i hastig vækst som kræftbehandlingsmetode og ikke mindst inden for hæmatologien. Desværre ser det ud til at have lange udsigter, før behandlingen bliver taget i brug herhjemme, og det vil koste dødsfald blandt lymfompatienter. Her fortæller overlæge Judit Jørgensen fra Hæmatologisk Afdeling på Aarhus Universitetshospital om perspektiver og udfordringer for den nye behandlingsform med særligt fokus på diffust storcellet B-celle-lymfom (DLBCL).
Det er snart 10 år siden, amerikanske læger første gang prøvede CAR-T-cellebehandling på et barn med akut lymfatisk leukæmi (ALL). Det var på 7-årige Emily Whitehead, der blev det første barn i et klinisk studie, der afprøvede CAR-T-cellebehandlingen CTL019. Historien om hendes helbredelse for en dødelig sygdom gik verden rundt. Emily er i mellemtiden blevet 16 år, og hun er fortsat rask.
Siden er det gået stærkt, og den komplicerede og ekstremt dyre behandlingsform har vundet frem og har blandt andet vist positive resultater i behandlingen af visse former for lymfe- og blodkræft. CAR-T-celleterapi beskrives på Rigshospitalets hjemmeside som ”et kæmpe teknologisk og medicinsk fremskridt, der flytter grænserne for, hvordan vi kan angribe kræftsygdom.”
Men træerne vokser som bekendt ikke ind i himlen, og i dag er CAR-T-cellebehandling ikke tilgængelig for danske lymfekræftpatienter eller for den sags skyld andre kræftpatienter bortset fra yngre patienter med akut lymfatisk leukæmi (ALL). Det er en modsætning til, hvad der gør sig gældende i en lang række lande i Europa, som vi ellers ynder at sammenligne os med. Til dato har kun én dansk DLBCL-patient været i CAR-T-cellebehandling. Det er Allan Nielsen, som du kan læse om i dette blad (og på LyLes hjemmeside lyle.dk).
Vi har ikke 3.-linjebehandling i Danmark i dag
”I den meget korte version, så er CAR-T-cellebehandling baseret på, at man høster patientens egne hvide blodlegemer, de såkaldte T-celler. Cellerne bliver genmodificeret i et laboratorium og tilført en form for virus, der bringer dem i stand til at genkende overfladestrukturer, som er særegne for kræftceller, og udrydde dem. De genmodificerede celler føres derefter tilbage til patienten via en blodtransfusion. På den måde kan T-cellerne rette et frontalt angreb mod kræftcellerne. Behandlingen skræddersys i sagens natur til den enkelte patient, og i modsætning til en lang række af de nye, meget effektive og målrettede (og dyre) kræftbehandlinger, der gives over meget lang tid og måske endda livslangt, så er en CAR-T-celleterapi en 1-gangsbehandling. Det er ikke uvæsentligt, når talen falder på prisen,” forklarer Judit Jørgensen.
Til DLBCL (og i øvrigt også til B-celle akut lymfatisk leukæmi (B-ALL) er der i dag to behandlinger godkendt til 3.-linjebehandling af DLBCL af Det Europæiske Lægemiddelagentur (EMA) og de amerikanske læge-middelmyndigheder (FDA), og en tredje er på vej til at blive det. De to første, Yescarta og Kymriah, ligner hinanden meget og er begge rettet mod CD19-molekylet på B-cellernes overflade. Yescarta forventes i øvrigt snart godkendt til mantlecellelymfom (MCL), og der er studier i gang på follikulært lymfom og kronisk lymfatisk leukæmi (CLL). Danske patienter – indtil videre kun én, der under helt særlige omstændigheder vil kunne tilbydes disse behandlinger – kunne sendes til behandling til USA, indtil Medicinrådet tog stilling til behandling.
Det er vigtigt at slå fast, at vi i dag ikke har en 3.-linje-behandling til DLBCL, men standardbehandling til linje 1 og 2. Det betyder med andre ord, at hvis en patient ikke har glæde af de to første behandlingslinjer, så er der ikke længere en standardbehandling at tilbyde. For at imødekomme dette, har man i mange år – desværre med dårlige resultater – forsøgt sig med varianter af kemo-behandlinger, som patienten ikke er blevet udsat for før.
Udviklingen har i øvrigt ført til studier, der sammenligner stamcelletransplantation med behandling med CAR-T-celler som 2.linjebehandling, så måske vil vi inden længe se, at CAR-T-cellebehandling overflødiggør stamcelletransplantation for patienter med tilbagefald af DLBCL.
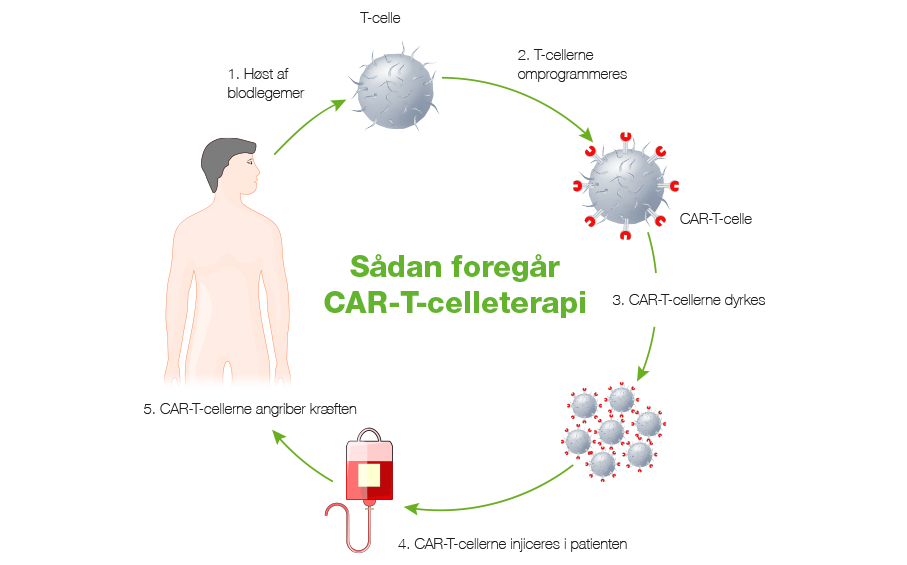
Sådan foregår CAR-T-celleterapi
Behandlingen starter med, at man høster patientens hvide blodlegemer (T-celler) og sender dem til et laboratorium.
Her bliver T-cellerne tilført en såkaldt vektorvirus, der omprogrammerer T-cellernes DNA, så de kan genkende leukæmicellernes – fx diffust storcellet B-celle lymfom (DLBCL) – CD19-receptorer.
De modificerede T-celler bliver dyrket og sendt retur til den behandlingsgivende afdeling.
Inden behandlingen går i gang, får patienten immundæmpende medicin for at svække kroppens immunfunktion, så de nye, og delvist fremmede, T-celler ikke bliver destrueret af patientens eget immunforsvar.
Nej fra Medicinrådet
For ét år siden afviste Medicinrådet CAR-T-cellebehandling til patienter med DLBCL, som ellers er en sygdom, hvor brugen af den nye, avancerede behandlingsform har vist bemærkelsesværdigt positive og holdbare resultater hos patienter med dårlig prognose, og hvor kemoterapi har en begrænset effekt.
Den gang udtalte Judit Jørgensen til Sundhedspolitisk Tidsskrift, at ”… det er meget ærgerligt, at CAR-T ikke er blevet godkendt som standardbehandling. Behandlingen virker hos en del patienter – cirka 40 procent bliver raske – og det ser ud til, at effekten holder på sigt, og at langtidsbivirkningerne er få. De fleste patienter, som har haft gavn af behandlingen, vender tilbage til arbejdsmarkedet. Der er et stort politisk fokus på målrettet og personlig medicin. CAR-T-cellebehandling opfylder i den grad begge dele. Så det er meget beklageligt, at behandlingen ikke bliver godkendt.”
Baggrunden for afvisningerne var, at Medicinrådet vurderede, at der ikke er et rimeligt forhold mellem den kliniske merværdi, der er vurderet som ‘ikke-dokumenterbar’, og omkostningerne ved behandlingerne, sammenlignet med bedste tilgængelige behandling.
Judit Jørgensen mener, at beslutningen om at afvise CAR-T-cellebehandling som standardbehandling rejser nogle kritiske spørgsmål omkring Medicinrådets metode.
”Rådet tildeler klinisk merværdi for den nye behandling i forhold til standardbehandling. Men der findes ingen standardbehandling, når det kommer til 3.linjebehandling af DLBCL. Her anvender man forskellige kemoterapikombinationer, men ingen af dem er undersøgt i større studier og godkendt til 3.-linjebehandling,” siger Judit Jørgensen.
Medicinrådet lægger i sin vurdering af CAR-T-cellebehandlingerne vægt på, at evidensens kvalitet er lav, og at der er behov for et mere solidt evidensgrundlag for at kunne vurdere den kliniske merværdi sammenlignet med den bedste tilgængelige behandling. Judit Jørgensen påpeger, at den dokumentation, som Medicinrådet kræver, er svær at skaffe for en så sjælden sygdom som tilbagefald af DLBCL, hvor der ikke findes en standardbehandling.
De anvendte behandlinger i 3. linje er forholdsvis billige traditionelle kemoterapier, derfor bliver prisforskellen mellem de nuværende behandlinger og CAR-T-celleterapi naturligvis også meget stor.
”Medicinrådets beslutninger hviler meget på et evidensgraderingssystem og en vurdering af merværdi. Men recidiverende (tilbagefald af) DLBCL er en sjælden sygdom med få patienter, så det er svært at skaffe dokumentation på fase III-niveau med langtidsopfølgning. Det nuværende vurderingssystem, som er anderledes end det, man anvender i andre lignende organisationer som fx NICE (det britiske prioriteringsinstitut, red.), betyder, at det er svært at få godkendt en ny behandling for sjældne sygdomme i Danmark,” siger Judit Jørgensen. Hun påpeger, at Medicinrådet i januar faktisk godkendte CAR-T-cellebehandling til børn med ALL på baggrund af et lignende studie og evidensgrundlag.
Hvad må et liv koste?
I forbindelse med Medicinrådets afvisning af Yescarta spurgte Sundhedspolitisk Tidsskrift LyLes formand, Rita O. Christensen, om, hvordan patientforeningen så på dette:
”Uden at blive alt for teknisk, så synes vi, at den måde, Medicinrådet har beregnet behandlingens effektivitet på, er meget mærkværdig. Vi hæfter os ved, at man tilsyneladende inddrager kontrolgruppen i det samlede resultat. Man siger, at så og så mange patienter har fået CAR-T-cellebehandling, og så mange har ikke – det vil sige kontrolgruppen – og så beregner man effektiviteten ud fra den samlede gruppe. Det er en meget mærkværdig måde at beregne det på,” siger Rita O. Christensen og fortsætter:
”Vi ser afvisningen som benhård økonomisk prioritering, og det strider imod vores holdning til, at danske patienter har ret til den bedst mulige behandling, som er godkendt af EMA (Det Europæiske Lægemiddelagentur). Vi ved godt, at CAR-T-cellebehandling er en meget dyr behandling, men hvem skal sætte pris på, hvad et liv må koste?”
LyLe har haft kontakt med paraplyorganisationen for lymfompatientforeninger i Europa, Tyrkiet og Israel, Lymphoma Coaliation Europe (LCE), vedrørende Medicinrådets afvisning af Yescarta. LCE oplyser blandt andet, at Novartis, som står bag Kymriah, i flere tilfælde har erklæret, at firmaet er villig til at samarbejde med sundheds- og godkendelsesmyndigheder i Europa om en fair, værdibaseret pristilgang, som er holdbar for de nationale sundhedssystemer.
Yescartas amerikanske listepris er $ 373.000 for DLBCL, mens der i Europa i øjeblikket drøftes og indgås forskellige prisstrategier for både Kymriah og Yescarta. Fx har man i Spanien indgået den aftale, at sundhedsvæsnet betaler 50 procent af prisen (60 procent ved pædiatrisk kræft) for en CAR-T-cellebehandling, og de øvrige 50 procent (eller 40 procent), hvis patienten opnår komplet remission (der kan ikke længere konstateres sygdom) 18 måneder efter en CAR-T-celleinfusion. Amgros har også forhandlet med firmaerne, men resultatet af disse forhandlinger er fortroligt, og vi kender ikke den danske pris for CAR- T-celle behandling.
Vinduet stod faktisk på klem i en kort periode
I perioden mellem, at EMA godkendte Yescarta og Kymriah, og Medicinrådet i Danmark behandlede ansøgningerne, var det faktisk muligt at sende patienter til udlandet, og på den måde kom to patienter afsted. Det skete med midler fra en særlige pulje fra Sundhedsstyrelsen, der åbner op for den mulighed. Men efter Medicinrådets afvisning af CAR-T-cellebehandling for lymfomer er det ikke længere muligt at sende patienter til udlandet. Der er to danske afdelinger, der i Sundhedsstyrelsens specialeplan er udpeget til at behandle lymfekræftpatienter med CAR-T: Rigshospitalet og Århus, men der mangler finansiering.
”I Dansk Lymfomgruppe har vi spurgt myndighederne og Sundhedsministeriet, hvad vi så kan gøre. Fra Sundhedsministeriet har de meldt tilbage, at Medicinrådet afgørelse ikke er en lov. Sundhedsstyrelsen har henvist til Danske Regioners ‘Vejledning om anvendelse af lægemidler, som ikke er anbefalet af Medicinrådet’ og udtalt: Hvis læger i en konference beslutter, at en patient skal have den behandling, så skal de søge om at få den betalt via regionens lægemiddelkomite,” forklarer Judit Jørgensen.
“Der er altså en teoretisk mulighed for at tilbyde patienter CAR-T-cellebehandling, men den er teoretisk. Regionernes Lægemiddelkommitte henviser nemlig til Medicinrådets beslutning og siger på den baggrund nej. Det har vi eksempler på, og er man en patient, der har brug for den behandling, så er chancerne for, at det kan lade sig gøre, nærmest lig nul. Sammenligner vi os med en lang række lande i Europa som Østrig, Frankrig, Italien, Spanien, Tyskland og Sverige virker det nærmest pinligt, at vi er faldet helt bagud i Danmark. Det kan vi ikke være bekendt, og vi kan nu bare vente på, at der kommer resultater fra randomiserede fase III-studier, hvor CAR-T-cellebehandlingen sammenlignes med stamcelletransplantation som 2.-linjebehandling. Hvis studiet viser positive resultaterr, bliver det meget svært at afvise CAR-T-cellebehandling for lymfompatienter, og forhåbentlig kan også tages i brug som 3.-linjebehandling i Danmark,” slutter Judit Jørgensen.